Innehåll
- vägbeskrivning
- Antal elektroner i valensskiktet
- Lewis struktur
- Formell laddning av varje atom
- varning
- Vad du behöver
Vid bestämning av den formella laddningen av en molekyl såsom CoCl2 (fosgengas) är det nödvändigt att känna till antalet elektroner i valensskiktet hos varje atom och molekylens Lewis-struktur.
vägbeskrivning
-
Leta efter varje atom i elementets periodiska tabell för att bestämma antalet elektroner i valensskiktet.
-
Minns att två elektroner är i den första delnivån s, två är i den andra delnivån s, sex elektroner i den första delnivån p, och så vidare. Minns: 1s (^ 2) 2s (^ 2) 2p (^ 6) 3s (^ 2) 3p (^ 6).
-
Hit lasten. Om molekylen är en jon, tillsätt eller subtrahera en eller flera elektroner från summan för att nå slutladdningen.
-
För CoCl2 (fosgen gas): C = 4; O = 6; Cl = 7. Molekylen är inte joniserad och har en neutral laddning. Därför är det totala antalet elektroner i valensskiktet 4 + 6 + (7x2) = 24.
Antal elektroner i valensskiktet
-
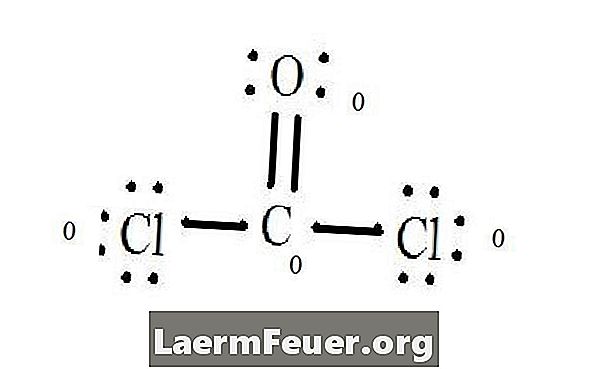
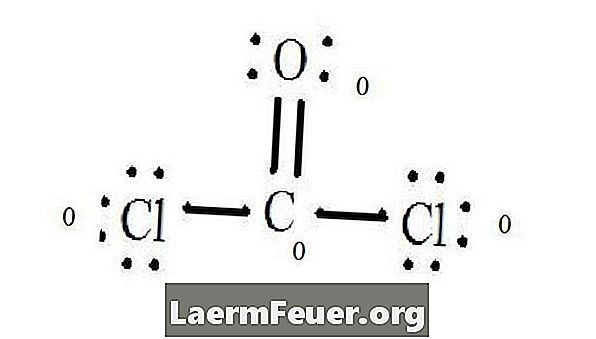
Se Lewis-strukturdiagrammet för CoCl2 (fosgengas). Lewis-strukturen representerar den mest stabila och sannolika strukturen för molekylen. Atomer ritas med parade valenselektroner; bindningar bildas mellan fria elektroner för att tillfredsställa oktettregeln.
-
Rita varje atom och dess valenselektroner och bilda sedan obligationer efter behov.
Elektroner ritade på Lewis-strukturen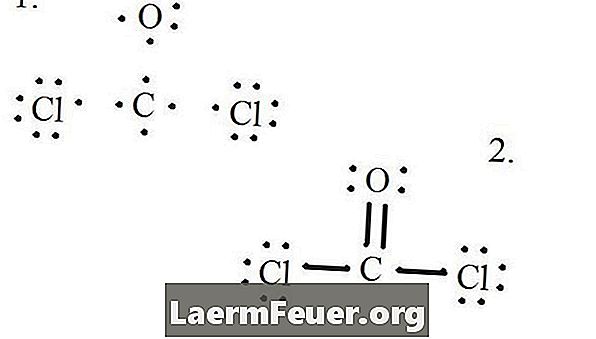
-
Kloridatomer delar enskilda bindningar med kolmolekylen, medan syreatomen bildar dubbelbindning med kol. Varje atom i den slutliga strukturen uppfyller oktettregeln och har åtta elektroner i valensskiktet, vilket möjliggör molekylär stabilitet.
Lewis struktur
-
Räkna de fria elektronparen i varje atom i Lewis-strukturen. Varje atom betecknar en elektron av varje bindning från vilken den deltar. Lägg till dessa nummer. I CoCl2: C = 0 fria par plus 4 bindningselektroner = 4 elektroner. O = 4 elektroner av fria par plus 2 elektroner av bindningar = 6 elektroner. Cl = 6 elektroner av fria par plus en elektron av ett bindemedel med C = 7 elektroner.
-
Subtrahera mängden antal elektroner i valensskiktet på den obundna atomen. Resultatet är den formella laddningen för varje atom. I CoCl2: C = 4 valenselektroner (ev) i obundet atom minus 4 elektroner betecknade i Lewis-strukturen (LS) = 0 formell laddning O = 6 ev - 6 LS = 0 formell laddning Cl = 7 och -7 LS = 0 formell avgift
Formella laddningar av atomer
-
När du skriver, placera dessa avgifter nära atomerna i Lewis-strukturen. Om totalt molekylen har en laddning, placera Lewis-strukturen i parentes med laddningen som är skriven på utsidan i övre högra hörnet.
Formell laddning av varje atom
varning
- Beräkningen av den formella avgiften för molekyler som innehåller övergångsmetaller kan vara förrädiska. Antalet elektroner i valensskiktet för övergångsmetaller kommer att utgöras av ädelgasmönstret.
Vad du behöver
- Periodisk tabell av elementen